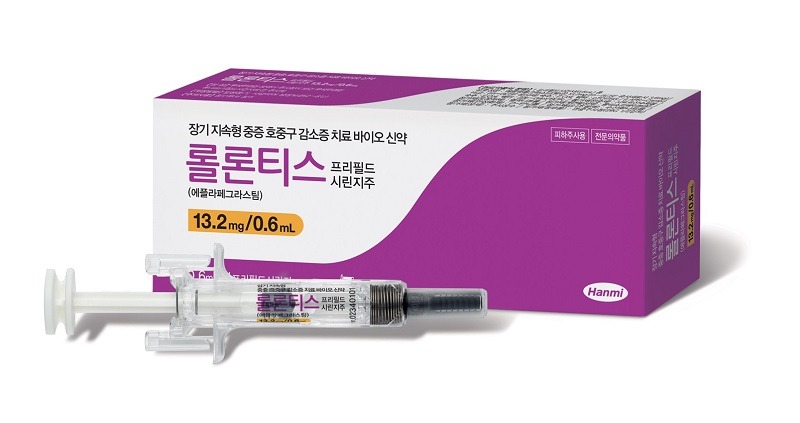
한미약품의 첫 바이오신약 ‘롤론티스’가 상용화됐다.
한미약품은 세포독성화학요법(항암화학요법) 투여 환자에서 발생할 수 있는 중증 호중구감소증의 발현 기간을 줄여주는 G-CSF 계열의 바이오신약 ‘롤론티스’를 출시했다.
롤론티스는 한미약품의 독자 플랫폼 기술인 ‘랩스커버리’가 적용된 장기 지속형 바이오신약으로, 항암 주기 당 1회 투여한다. 기존 약제 대비 G-CSF의 투여 용량은 줄이면서도 효능을 높여 암 환자들의 삶의 질 개선에 기여할 것으로 기대된다. 랩스커버리는 반감기가 짧은 바이오의약품의 생체 내 지속성을 최장 월1회까지 늘려주는 기술로, 현재 한미약품이 개발 중인 10여개 바이오신약 파이프라인에 적용돼 있다.
이번 롤론티스의 한국 출시에 따라, 한미약품은 항암치료 부작용인 비정상적으로 감소하는 호중구 수치를 회복시킬 수 있는 예방적 처방의 새로운 옵션을 제공할 수 있게 됐다.
또 경쟁 약물 대비 개선된 주사바늘 안전덮개(세이프티 가드) 적용으로 투약 방법 및 투약 이후 처리 편의성 개선과 함께 2세대 호중구 감소증치료제 대비 최대 37% 경제적 약가를 적용해 건강보험 재정 및 환자들의 경제적 부담도 절감했다.
롤론티스의 원료의약품 및 완제품 생산은 다수의 ISO 및 GMP 인증을 받은 한미약품 평택 바이오플랜트가 맡는다.
한미약품 관계자는 “랩스커버리 기술이 적용된 첫 상용화 의약품인 롤론티스에 아주 경제적인 보험 약가를 적용했으며, 급여 혜택을 받지 못하는 환자들을 위해서는 약제비 지원 프로그램(한국혈액암협회-약제비지원사업)도 시행해 3세대 호중구감소증 치료신약으로 확고히 자리매김 할 수 있도록 노력하겠다”고 말했다.
롤론티스는 호중구감소증이 발생한 초기 유방암 환자 643명을 대상으로 진행된 두 건의 글로벌 임상 3상 시험의 통합분석에서 경쟁약물 대비 제1주기 DSN(Duration of Severe Neutropenia, 중증 호중구감소증 발현기간)의 비열등성 및 통계적 우월성, 우수한 중증 호중구감소증 상대적 위험율 감소를 입증한 바 있다. 또 글로벌 임상 3상 시험 사후 분석에서는 전체 임상 결과와 한국인 소그룹에서의 치료 효과 및 안전성이 일관됨을 입증했다.
한미약품 권세창 사장은 “롤론티스는 한미약품의 축적된 R&D 노하우와 독자 기술인 랩스커버리가 적용된 제품 중 처음으로 상용화되는 의미 있는 신약”이라며 “한국에서의 성공적 발매를 거쳐 글로벌에서 인정받는 한미 최초의 바이오 신약이 되도록 노력하겠다”고 말했다.
한미약품은 이번 롤론티스 한국 출시를 시작으로 미국 등 글로벌 출시를 위한 절차도 순조롭게 진행해 나간다는 계획이다. 롤론티스는 2012년 미국 제약바이오기업 스펙트럼에 기술수출 돼 현재 FDA 시판허가를 위한 막바지 절차를 밟고 있다.
<저작권자 ⓒ 헬스위크, 무단 전재 및 재배포 금지>
오혜나 기자 다른기사보기